Étude expérimentale animale
| Chen Z1, Yao K1, Wang X2, Liu Y1,3,4,5, Du S1, Wang S1,3,4,5, Fang Y1,3,4,5, Xu Y1,3,4,5, Xu Z1,3,4,5, Lin X1,3,4,5, Guo Y3,4,5. Acupuncture promotes muscle cells ATP metabolism in ST36 acupoint local exerting effect by activating TRPV1/CaMKII/AMPK/PGC1α signaling pathway. Chin Med. 2025 Jul 14;20(1):112. [1] |
2State Key Laboratory of Component-Based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin, 301617, China.
3Research Center of Experimental Acupuncture Science, Tianjin University of Traditional Chinese Medicine, Tianjin, 301617, People's Republic of China.
4Tianjin Key Laboratory of Modern Chinese Medicine Theory of Innovation and Application, Tianjin, 301617, People's Republic of China.
5National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin, 300381, People's Republic of China.
Par une série d’expériences coordonnées, une équipe de l’Université de Médecine Chinoise de Tianjin démontre que l’effet antalgique du point 36E est maximal lorsque la puncture atteint la couche musculaire. Cette stimulation active les récepteurs TRPV1 des myocytes et déclenche, via une cascade intracellulaire, la production et la libération locale d’ATP. Pour le praticien, ce mécanisme évoque deux manifestations cliniques liées à la puncture : le deqi et le saisissement de l’aiguille.
L'étude
Contexte
L’effet antalgique du point 36E (zusanli) est solidement documenté notamment dans les modèles inflammatoires murins. Toutefois les mécanismes précoces de transduction mécanique au niveau local, en particulier les cellules impliquées et les voies de signalisation activées, demeurent mal caractérisés.
Objectif
L’étude explore si l’activation locale de TRPV1 (Transient Receptor Potential Vanilloid 1) au 36E est une condition nécessaire et suffisante pour déclencher une analgésie et cherche à identifier les types cellulaires et les voies moléculaires impliqués.
Modèle expérimental
- Un modèle murin de douleur inflammatoire a été induit par injection de CFA (Complete Freund’s Adjuvant) dans la plante du pied.
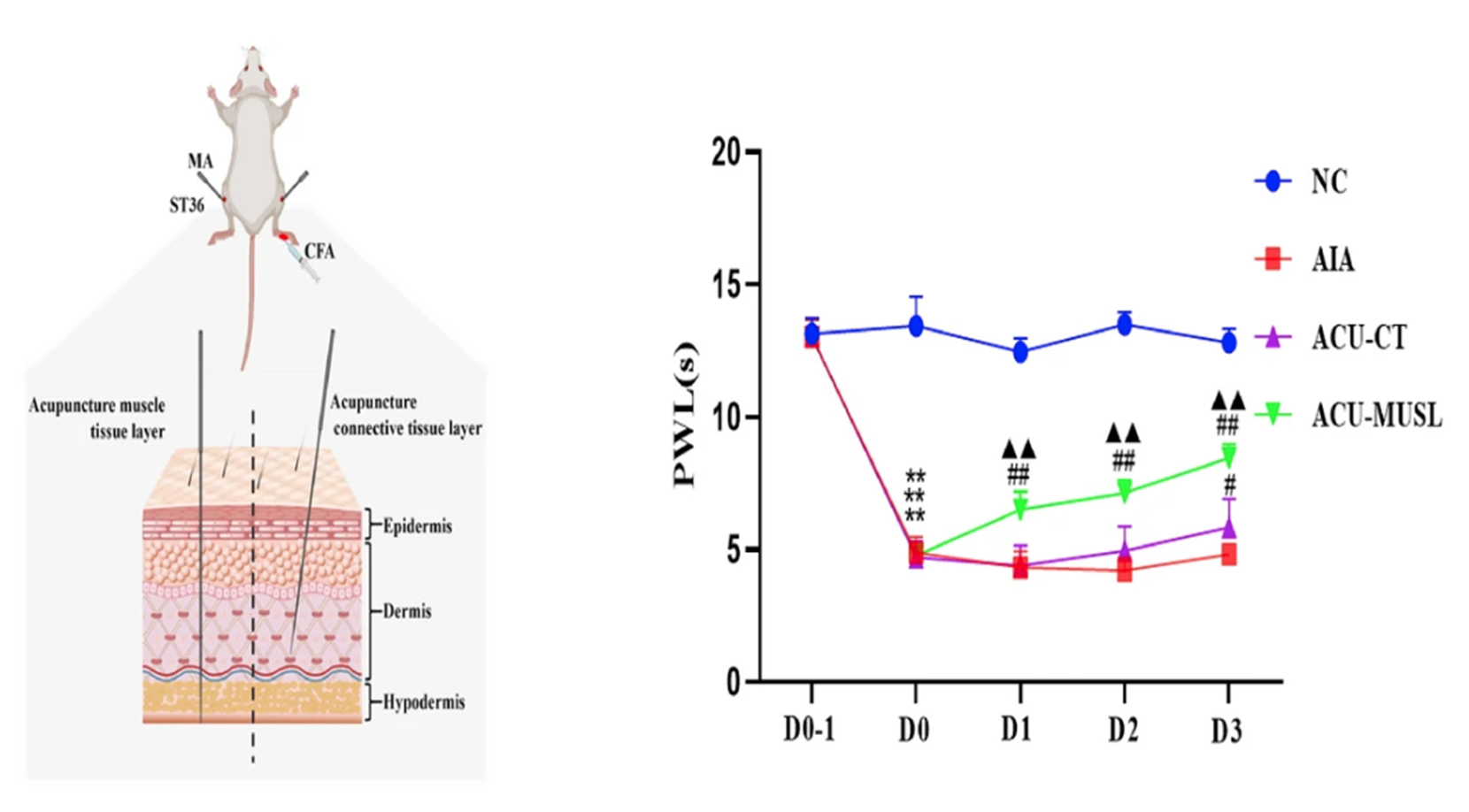
- L’acupuncture a été pratiquée bilatéralement au 36E, avec une stimulation manuelle standardisée, une séance par jour sur 3 jours (figure 1).
- L'effet antalgique de l'acupuncture a été évalué à l’aide de tests de sensibilité thermique (Hargreaves) et mécanique (von Frey) (▶ 1).
1. Tests de sensibilité thermique et mécanique
Test de sensibilité mécanique (Test de von Frey)
Ce test évalue la sensibilité mécanique en appliquant, sur la surface plantaire, des filaments calibrés exerçant une pression croissante. Le seuil de retrait correspond à la force minimale nécessaire pour déclencher le retrait réflexe de la patte. Une diminution de ce seuil traduit une allodynie mécanique.
Test de sensibilité thermique (Test de Hargreaves)
Ce test évalue la sensibilité thermique en appliquant, sous la patte, une source de chaleur infrarouge à travers une plaque de verre transparente. La latence de retrait correspond au temps écoulé avant le retrait réflexe de la patte. Une diminution de cette latence traduit une hypersensibilité thermique.
Résultats
L’acupuncture au 36E induit une réponse antalgique mesurable dans le modèle inflammatoire. Cinq volets expérimentaux permettent de caractériser les mécanismes en jeu :
1- TRPV1 est requis pour l’effet antalgique
- L’acupuncture au point 36E induit une élévation significative des seuils de retrait thermique et mécanique chez les souris traitées traduisant un effet antalgique (figure 4).
- Elle s’accompagne d’une augmentation de l’expression de l’ARNm de TRPV1 (figure 5).
- L’injection locale de l’antagoniste de TRPV1 (AMG9810) entraîne une inhibition dose-dépendante de l’effet antalgique.
Ces résultats indiquent que l’activation de TRPV1 au 36E est indispensable pour déclencher l’effet antalgique (▶ 2).
2. Les récepteurs TRPV1
Les récepteurs Transient Receptor Potential Vanilloid 1 (TRPV1) sont des canaux ioniques membranaires, présents surtout dans les fibres nerveuses sensitives mais aussi dans d’autres cellules, comme les macrophages les mastocytes, les fibroblastes et les myocytes.
Ils sont activés par la chaleur (> 43 °C), un pH acide (< 5,9), la capsaïcine et certains médiateurs endogènes. Leur ouverture permet une entrée rapide de calcium (Ca²⁺) et déclenche une cascade de signaux intracellulaires modulant l’excitabilité cellulaire et la libération de médiateurs.
Pour centrer leur étude sur TRPV1, les auteurs ont préalablement sélectionné cinq canaux ioniques mécanosensibles identifiés dans la littérature (TRPV1, TRPV2, TRPV4, Piezo1, Piezo2) et mesuré leur expression après stimulation du point 36E. L’analyse a combiné RT-qPCR pour les transcrits et Western blot pour la confirmation protéique. Seuls TRPV1 et Piezo1 étaient augmentés, avec une hausse plus marquée pour TRPV1, ce qui a motivé le choix de se concentrer sur ce récepteur.
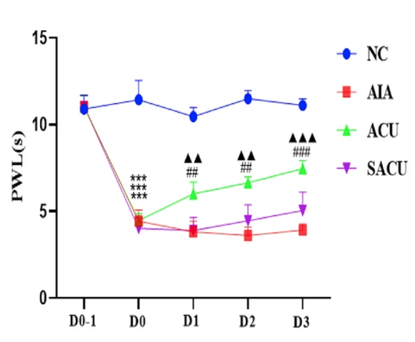
Le groupe ■AIA (modèle d’arthrite induite) présente une diminution marquée et persistante de la latence de retrait à un stimulus thermique, traduisant une hypersensibilité thermique, tandis que le groupe ●NC (contrôle sain, sans intervention) conserve une latence élevée et stable.
L’acupuncture avec manipulation au 36E (groupe ▲ACU) induit une augmentation significative de la latence dès le jour 1, maintenue jusqu’au jour 3. En revanche, une insertion simple sans manipulation sur un non-point situé à 2 mm du 36E (groupe ▼SACU) n’entraîne aucune modification par rapport au modèle.
Ces résultats indiquent que seule l’acupuncture réelle au 36E déclenche un effet antalgique mesurable dans ce modèle inflammatoire.
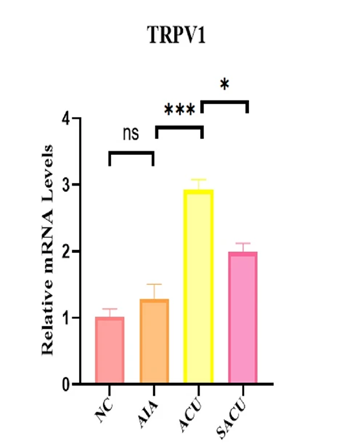
Le graphique compare les niveaux relatifs d’expression de l’ARNm de TRPV1 au 36E, mesurés par amplification quantitative en temps réel (RT-qPCR) dans quatre groupes de souris.
Le groupe contrôle sain ■NC et le groupe arthrite induite non traité ■AIA présentent des niveaux d’expression bas et comparables (ns, non significatif).
Le groupe traité par acupuncture réelle ■ACU montre une élévation significative de l’expression de TRPV1 par rapport au groupe modèle ■AIA (p < 0,001) et au groupe fausse acupuncture ■SACU (p < 0,05).
Ces résultats confirment que seule l’acupuncture réelle induit une surexpression locale de TRPV1, impliquée dans l’effet antalgique.
2- L’effet antalgique optimal est obtenu par une puncture au niveau musculaire
- Une puncture à 3 mm de profondeur (chez la souris au niveau de la couche musculaire) entraîne une augmentation significative des seuils de sensibilité mécanique et thermique.
- Une puncture superficielle (<1,5 mm, au niveau fascial) induit une élévation modeste de ces seuils, observée uniquement au jour 3.
- L’administration locale de succinylcholine (relaxant musculaire) inhibe la réponse antalgique et s’accompagne d’une réduction de l’expression de TRPV1 et de sa forme phosphorylée (pTRPV1) au niveau des myocytes.
Ces données suggèrent que l’effet antalgique optimal requiert à la fois une stimulation musculaire et l’intégrité fonctionnelle du tissu contractile.
Le graphique montre l’évolution de la latence de retrait à un stimulus thermique (PWL, en secondes) chez des souris avec un modèle d’arthrite inflammatoire réparties en quatre groupes expérimentaux.
Le groupe contrôle sain ●NC conserve une latence élevée et stable au cours du temps. Le groupe arthrite induite non traité ■AIA présente une diminution marquée et persistante de la latence, traduisant une hypersensibilité thermique (p < 0,001 vs NC).
Le groupe traité par acupuncture superficielle (fascia) ▲ACU-CT montre une augmentation significative de la latence à J3 (p < 0,05 vs AIA). Le groupe traité par acupuncture profonde (muscle) ▼ACU-MUSL présente une augmentation significative dès J1 (p < 0,01 vs AIA), avec un effet renforcé aux jours suivants (p < 0,01 à p < 0,001 vs AIA ; p < 0,05 à p < 0,01 vs ACU-CT).
Ces résultats indiquent qu’un effet antalgique optimal est obtenu par une puncture atteignant la couche musculaire mais que l’acupuncture superficielle induit également un effet antalgique, plus tardif et moins marqué.
3- TRPV1 est exprimé préférentiellement par les myocytes au niveau du 36E
- Pour identifier les cellules exprimant localement TRPV1, les auteurs ont eu recours à une analyse en double immunofluorescence, permettant de visualiser simultanément TRPV1 et un marqueur cellulaire spécifique dans une même coupe tissulaire.
- Quatre types cellulaires ont été analysés : les myocytes (marqués par la desmine), les fibroblastes (vimentine), les macrophages (F4/80) et les mastocytes (AA1).
- Après acupuncture, une co-localisation significative de TRPV1 n’est observée qu’avec la desmine, tandis qu’aucun chevauchement notable n’est détecté avec les autres marqueurs.
- Le nombre de cellules musculaires exprimant TRPV1, telles qu’identifiées par la co-localisation avec la desmine, augmente significativement après acupuncture.
Ces résultats indiquent que l’expression de TRPV1 induite par acupuncture au 36E se produit préférentiellement dans les cellules musculaires.
4 – L’acupuncture stimule la production d’ATP dans les myocytes via la voie TRPV1/CaMKII/AMPK/PGC1α
- L’analyse protéomique et phosphoprotéomique des tissus musculaires au 36E révèle, après acupuncture, une modulation différentielle de plusieurs voies intracellulaires impliquées dans le métabolisme énergétique.
- Les données mettent en évidence une activation séquentielle de la cascade TRPV1 → CaMKII → AMPK → PGC1α, identifiée par enrichissement phosphoprotéomique et confirmée par Western blot. Une augmentation significative des niveaux de CaMKII, d’AMPK phosphorylé (pAMPK) et de PGC1α est observée dans les extraits musculaires après puncture.
- Parallèlement, les dosages ELISA montrent une élévation marquée des concentrations d’ATP et d’adénosine dans les tissus musculaires après acupuncture.
3- Une séquence d’analyse moléculaire des effets de l’acupuncture
L’étude utilise plusieurs techniques complémentaires pour analyser les effets moléculaires de l’acupuncture et établir leur lien avec une réponse métabolique fonctionnelle.
Protéomique et phosphoprotéomique
La protéomique permet de détecter les voies intracellulaires activées par l’acupuncture. Elle dresse une cartographie dynamique des protéines mobilisées dans le tissu stimulé ce qui aide à identifier les mécanismes biologiques impliqués localement.
Western blot
Le Western blot permet de confirmer l’expression ou l’activation de protéines cibles par une détection spécifique. Il valide les résultats de la protéomique en mesurant directement, dans les tissus, le niveau de certaines protéines d’intérêt.
ELISA (dosage immuno-enzymatique)
L’ELISA permet de mesurer avec précision la concentration de médiateurs biochimiques extracellulaires, comme l’ATP ou l’adénosine. Elle renseigne sur la réponse métabolique induite localement par la stimulation.
En les combinant, ces approches permettent de relier l’activation locale de TRPV1 dans les myocytes à une production accrue d’ATP.
Ces résultats montrent que l’activation de la voie TRPV1 dans les myocytes induite par l’acupuncture s’accompagne d’une stimulation du métabolisme mitochondrial et d’une production accrue d’ATP. Cette production locale constitue un marqueur fonctionnel de la réponse au point stimulé susceptible de contribuer à l’effet antalgique.
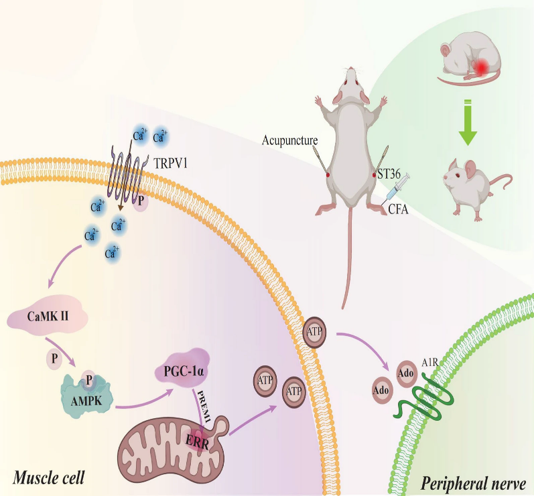
Le schéma illustre la voie TRPV1 → CaMKII → AMPK → PGC1α identifiée dans cette étude, expliquant le mécanisme de l’effet antalgique de l’acupuncture au 36E dans le modèle d’arthrite induite par injection de CFA chez la souris.
L’acupuncture active le canal TRPV1 à la surface des cellules musculaires, entraînant une entrée de calcium intracellulaire. Cette élévation de Ca²⁺ induit l’activation séquentielle de la protéine kinase CaMKII, de l’AMPK phosphorylée et du coactivateur transcriptionnel PGC-1α. Ce dernier stimule l’activité mitochondriale via l’activation de la voie ERRα et augmente la production d’ATP.
L’ATP ainsi libéré dans l’espace extracellulaire est rapidement converti en adénosine qui se lie aux récepteurs A1R exprimés sur les nerfs périphériques, contribuant à l’effet antalgique.
Le schéma met en évidence l’importance du couplage entre signalisation calcique, métabolisme énergétique mitochondrial et neuromodulation purinergique dans l’analgésie induite par l’acupuncture (voir encadré suivant).
5- L’activation de TRPV1 musculaire est nécessaire et suffisante pour induire l’effet antalgique
Les expériences précédentes ont mis en évidence une voie métabolique impliquant la cascade TRPV1 → CaMKII → AMPK → PGC1α. Il a ensuite été vérifié si l’activation isolée de cette voie pouvait reproduire l’effet antalgique et si son inhibition ciblée en empêchait l’apparition.
- La simple injection locale d’AICAR, un activateur pharmacologique d’AMPK, reproduit l’effet antalgique de l'acupuncture mesuré par les tests comportementaux. Elle s’accompagne d’une augmentation significative des concentrations locales d’ATP et d’adénosine.
- Inversement, l’injection locale d’un vecteur viral (AAV, ▶ 4) conçu pour bloquer spécifiquement l’expression de TRPV1 dans les myocytes inhibe l’effet antalgique de l’acupuncture ainsi que l’activation de la cascade CaMKII/AMPK/PGC1α et l’élévation des concentrations locales d’ATP et d’adénosine.
4- Blocage ciblé par vecteur AAV
Pour bloquer spécifiquement l’expression de TRPV1 dans les myocytes, les chercheurs ont conçu un vecteur viral de type AAV (adeno-associated virus) spécialement développé pour cette étude. Ce vecteur transporte un ARN interférent (shRNA) ciblant TRPV1, permettant ainsi d’inhiber sa production uniquement dans les cellules musculaires locales.
Cette méthode réduit l’expression de TRPV1 dans les myocytes du point 36E sans affecter les autres types cellulaires ni les tissus éloignés.
Ces données croisées montrent que TRPV1 musculaire est indispensable à l’effet antalgique de l’acupuncture et que l’activation de la voie métabolique en aval (AMPK/PGC1α) suffit à reproduire cet effet.
Conclusions
L’étude montre que l’effet antalgique de l’acupuncture est initié par l’activation de TRPV1 dans les myocytes, ce qui déclenche une cascade intracellulaire impliquant CaMKII, AMPK et PGC1α, aboutissant à la libération locale d’ATP. Cette production locale d’ATP dans le tissu musculaire au 36E pourrait constituer un signal clé dans la modulation de la douleur.
Commentaires
Approche mécanistique du point d’acupuncture
L’étude ici commentée s’inscrit dans ce qu’on peut désormais qualifier d’approche mécanistique du point d’acupuncture. Jusqu’à la fin du XXᵉ siècle, la plupart des recherches visaient à identifier une structure ou une caractéristique anatomique ou histologique propre au point en le comparant à un « non-point ». Depuis une quinzaine d’années un basculement s’est opéré : l’enjeu n’est plus tant de définir morphologiquement le point d’acupuncture que de le caractériser fonctionnellement, en étudiant directement ce qui s’y produit au contact de l’aiguille. Autrement dit, l’objet d’étude n’est plus le point envisagé isolément, mais bien l’unité opératoire formée par le couple point–aiguille. Le point devient, par l’action de l’aiguille, le site de conversion d’un signal mécanique en réponse biologique, elle-même à l’origine de l’effet thérapeutique. En retour, c’est l’analyse fine des conditions et des étapes de cette mécanotransduction qui permet de mieux comprendre la nature du point, ses caractéristiques spatiales, mais aussi la dynamique de sa réponse.
Ce changement de perspective est induit par l’émergence de technologies avancées, rapidement intégrées à la recherche expérimentale en acupuncture — témoignant, si besoin était, de la légitimité scientifique du domaine. Il s’appuie sur un ensemble cohérent de méthodes issues de la modélisation animale (manipulations génétiques ou pharmacologiques ciblées, optogénétique), de la biologie moléculaire (PCR, extinction génique), de l’imagerie cellulaire (immunofluorescence, histochimie), de la biochimie (dosages dynamiques de médiateurs et immunoblots ciblés) et du profilage global (protéomique, phosphoprotéomique). Ce socle technologique autorise désormais une exploration spatio-temporelle intégrée des événements biologiques déclenchés localement par la puncture.
La mécanotransduction
L’étude de Chen et al. (2025) illustre de façon exemplaire cette approche mécanistique en analysant le rôle des myocytes dans la conversion du signal mécanique. Les auteurs montrent que l’activation du canal mécanosensible TRPV1 dans les fibres musculaires déclenche une cascade de signalisation intracellulaire conduisant à la libération d’ATP dans le tissu musculaire. Cet ATP constitue un relais essentiel vers l’activation des récepteurs purinergiques et participe de façon démontrée à l’effet antalgique observé à distance (voir encadré suivant).
Mise en évidence du rôle de l’eATP musculaire dans l’induction de l’effet antalgique de l’acupuncture (Zuo WM et al., 2023)
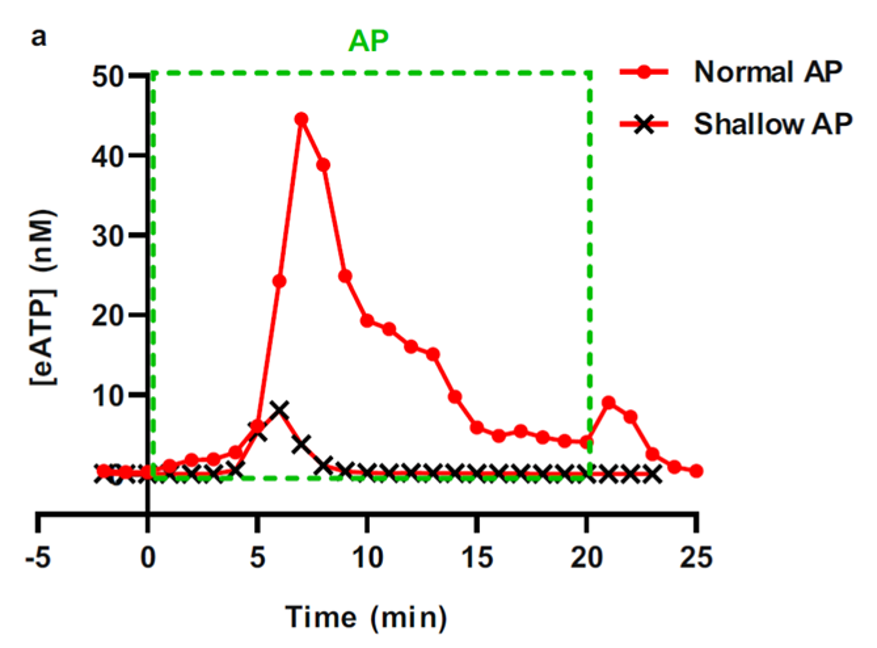
Dans une étude publiée en 2023, Zuo et al. [2] ont apporté une démonstration expérimentale déterminante sur les mécanismes périphériques de l’analgésie par acupuncture. Leur objectif était de suivre la libération d’ATP extracellulaire (eATP) lors de la puncture du point 36E et d’en évaluer le rôle dans l’initiation de l’effet antalgique.
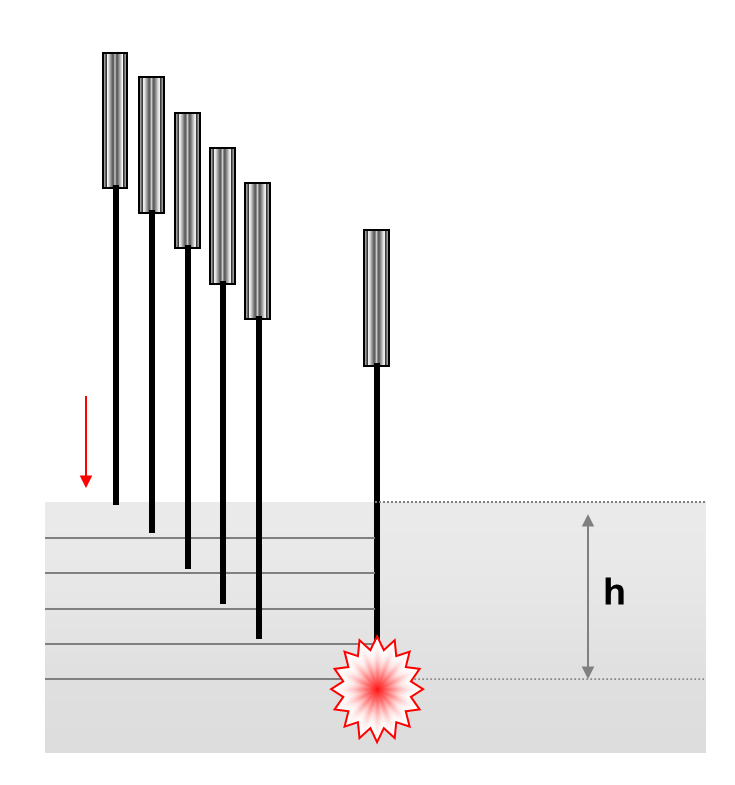
L’innovation méthodologique majeure de cette étude réside dans l’utilisation d’un système de microdialyse couplé à une puce microfluidique permettant de suivre en continu la concentration d’ATP interstitiel. Les résultats montrent qu’une stimulation du point 36E induit un pic marqué de libération d’eATP, apparaissant en moyenne cinq minutes après la puncture et la fin de la manipulation de l’aiguille. Ce pic n’est observé qu’en cas de puncture profonde atteignant la couche musculaire (5 à 7 mm) tandis qu’une puncture superficielle (1 à 1,5 mm) n’entraîne qu’une augmentation modeste (figure 8). Le muscle squelettique apparaît ainsi comme la source principale d’eATP libéré au 36E.
L’étude montre également que l’effet antalgique ne dépend pas uniquement de la libération d’eATP mais aussi de sa transformation en adénosine. Cette hydrolyse est indispensable : lorsqu’elle est inhibée (par ARL67156) l’effet disparaît. À l’inverse, la simple hydrolyse de l’eATP par une enzyme (apyrase) suffit à reproduire une partie de l’effet antalgique de l’acupuncture sans intervention d’aiguille.
La libération d’eATP au point 36E est par ailleurs amplifiée en contexte pathologique comme dans le modèle d’arthrite induite à distance. Il s’agit d’un phénomène de sensibilisation qui pourrait expliquer l’efficacité accrue de l’acupuncture dans certaines situations inflammatoires.
L’étude de Chen Z et al., 2025 prolonge ces résultats en décrivant le mécanisme intracellulaire en amont de la libération de l’eATP. Elle confirme le rôle du tissu musculaire dans l’induction de l’effet antalgique de l’acupuncture et identifie précisément les myocytes comme origine cellulaire de l’eATP.
Ces résultats s’inscrivent dans un ensemble de travaux ayant mis en évidence d’autres acteurs et mécanismes impliqués dans la mécanotransduction que ce soit du côté des récepteurs mécanosensibles (TRPV2, intégrines, molécules d’adhésion, fibres de collagène), des cellules impliquées (mastocytes, fibroblastes), ou encore des médiateurs biochimiques libérés (histamine, ATP, sérotonine, cytokines) [3, 4].
Cette complexité traduit sans doute une pluralité de mécanismes sous-jacents. Les résultats expérimentaux suggèrent que ces mécanismes peuvent être activés de façon différenciée selon certains paramètres : profondeur de la puncture, modalité de manipulation de l’aiguille, durée et rythme de la stimulation. L’étude de Chen et al. (2025) met ainsi en évidence un mécanisme caractéristique de la puncture profonde au niveau musculaire avec implication des myocytes. Mais il est évident que d'autres mécanismes sont impliquée en cas de puncture superficielle avec évitement du deqi comme par exemple dans la puncture sous-cutanée de Fu [5].
Phénoménologie clinique associée : deqi et saisissement de l’aiguille
L’étude de Chen et al. (2025) montre que l’effet antalgique au point 36E est maximal lorsque la puncture atteint la couche musculaire. L’activation de récepteurs mécanosensibles des myocytes déclenche alors la libération d’ATP, mécanisme aboli par un myorelaxant, ce qui souligne la nécessité d’une activité musculaire effective.
Cette double exigence — profondeur et engagement musculaire effectif — renvoie directement à deux manifestations associées à la puncture : le deqi, sensation spécifique décrite par le patient et le saisissement de l’aiguille, perçu par le praticien comme une résistance ou une tension localisée autour de la pointe. On peut considérer que cette phénoménologie constitue le corrélat clinique du processus biologique sous-jacent. Un élément clé réside dans la profondeur précise à laquelle le deqi se manifeste, ce qui circonscrit l'induction du phénomène dans l’espace (voir encadré).
Le deqi désigne une sensation caractéristique ressentie par le patient lors de la puncture — typiquement un engourdissement, une lourdeur ou une distension — distincte de la simple sensation de piqûre ressentie à l’effraction cutanée. Il s’agit d’une sensation perceptible et identifiable par la quasi-totalité des sujets et qui obéit à la loi du tout ou rien (le deqi est perçu ou non). Décrit dès les premiers traités d’acupuncture il est classiquement un repère opératoire important et est considéré comme un vecteur de l’efficacité thérapeutique.
L’obtention du deqi nécessite une insertion lente et progressive de l’aiguille, millimètre par millimètre. À un certain niveau d’implantation le phénomène se déclenche, déterminant la profondeur du deqi. Dans les études, cette mesure peut être relevée cliniquement ou par échographie. Les données expérimentales montrent que la profondeur du deqi est cohérente avec les profondeurs de puncture indiquées dans les classiques de l’acupuncture.
L’induction du deqi est donc spatialement déterminée.
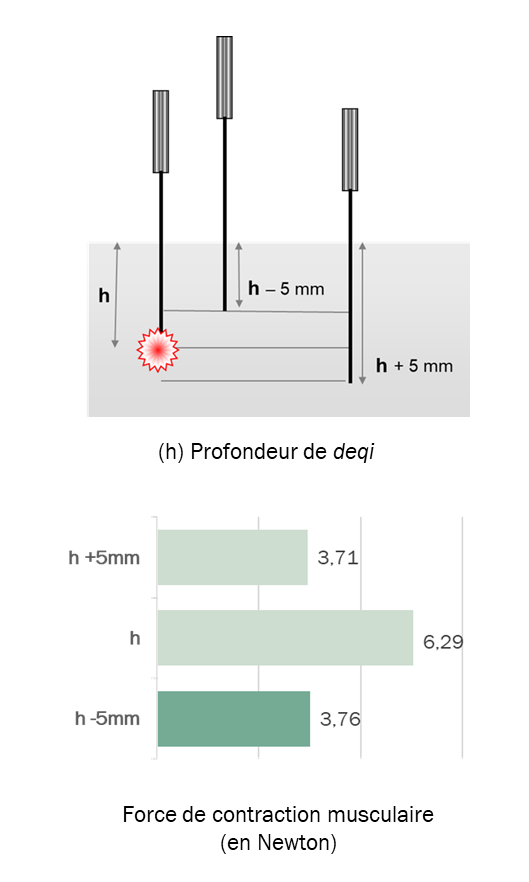
Une étude, réalisée chez 73 volontaires sains, a examiné comment la profondeur d’insertion de l’aiguille influence l’intensité de la contraction musculaire induite par électrostimulation au point 36E (zusanli).
Pour chaque participant, la profondeur correspondant à l’obtention du deqi (h) a été identifiée, puis comparée à deux insertions décalées : 5 mm moins profonde (h – 5 mm) et 5 mm plus profonde (h + 5 mm). Les trois positions ont été stimulées selon des paramètres électriques identiques, et la contraction musculaire du mollet a été mesurée par capteur de force. Chaque profondeur a été testée pendant une minute, la valeur retenue étant la moyenne des trois amplitudes maximales observées.
Les résultats montrent une contraction musculaire maximale à la profondeur h (6,29 N), environ 70 % plus élevée que celle obtenue aux profondeurs décalées (3,76 N et 3,71 N).
Le niveau h (en moyenne 2,73 cm ± 0,59 cm) apparaît ainsi comme un point de convergence entre la perception clinique du deqi et la réponse musculaire maximale objectivée expérimentalement. Cette réponse pourrait refléter une zone d’hyperréactivité musculaire dont la stimulation, en pratique clinique, est susceptible de déclencher le saisissement de l’aiguille.
L'essentiel à retenir
L’étude s’inscrit dans une approche mécanistique du point d’acupuncture centrée sur l’unité opératoire point–aiguille.
L’acupuncture au point 36E induit un effet antalgique dans un modèle murin de douleur inflammatoire, effet maximal lorsque la puncture atteint la couche musculaire.
Cet effet repose sur l’activation de TRPV1 dans les myocytes déclenchant la production et la libération locale d’ATP via la voie CaMKII/AMPK/PGC1α.
Ce mécanisme peut trouver son corrélat clinique dans le deqi, ressenti par le patient, et le saisissement de l’aiguille, perçu par le praticien.
Dr Johan Nguyen
Références
- Chen Z, Yao K, Wang X, Liu Y, Du S, Wang S, Fang Y, Xu Y, Xu Z, Lin X, Guo Y. Acupuncture promotes muscle cells ATP metabolism in ST36 acupoint local exerting effect by activating TRPV1/CaMKII/AMPK/PGC1α signaling pathway. Chin Med. 2025 Jul 14;20(1):112. https://doi.org/10.1186/s13020-025-01169-z 🔓
- Zuo WM, Li YJ, Cui KY, et al. The real-time detection of acupuncture-induced extracellular ATP mobilization in acupoints and exploration of its role in acupuncture analgesia. Purinergic Signal. 2023;19:69–85. https://doi.org/10.1007/s11302-021-09833-3
- Nguyen J. Quels paramètres pour une manipulation de l’aiguille par enfoncement-retrait à visée antalgique ? Acupuncture Preuves & Pratiques. Février 2025. https://gera.fr/quels-parametres-pour-une-manipulation-de-laiguille-par-enfoncement-retrait-a-visee-antalgique/ 🔓
- Nguyen J, Goret O. Base neuroanatomique de la sélectivité/spécificité du point : une avancée majeure dans la compréhension de l’acupuncture. Acupuncture Preuves & Pratiques. Janvier 2022. 🔓https://gera.fr/acupuncture-bases-neuroanatomiques/ 🔓
- Goret O, Nguyen J. Traitement de l’épicondylite par la puncture sous-cutanée de Fu. Acupuncture Preuves & Pratiques. Janvier 2023. https://gera.fr/acupuncture-et-epicondylite-2-technique-fu/ 🔓
- Nguyen J. L’obtention du deqi au 6MC n’est pas en relation avec la position de l’aiguille par rapport au nerf. Acupuncture & Moxibustion. 2007;6(3):259. https://gera.fr/wp-content/uploads/2025/08/nguyen-147133.pdf 🔓
- Deng LF, Zhou JF. [Effect of Qi arrival produced by electroacupuncture at Zusanli on muscular contractility]. Shanghai J Acu-mox. 2010 Oct;29(10):668-9.
Mots-clés : Acupuncture expérimentale- mécanismes d'action - Douleur - Points