Revue narrative
| Ke C1, Shan S1, Tan Y1, Cao Y1, Xie Z1, Shi S1, Pan J1, Zhang W1. Signaling pathways in the treatment of Alzheimer's disease with acupuncture: a narrative review. Acupunct Med. 2024 Jun 10:9645284241256669. |doi| |
L'étude
Contexte
La maladie d'Alzheimer est une affection neurodégénérative évolutive sans traitement curatif efficace connu à ce jour. La prévalence croissante de cette maladie en fait un enjeu majeur de santé publique. L'acupuncture, suscite un intérêt croissant en raison de ses effets potentiels sur divers aspects des manifestations pathologiques de la maladie d'Alzheimer.
Objectif
L'objectif est de résumer les principales cibles et voies de signalisation impliquées dans le traitement de la maladie d'Alzheimer par l'acupuncture.
Méthode
Il s'agit d'effectuer une revue narrative des études expérimentales disponibles sur les effets de l'acupuncture dans le traitement de la maladie d'Alzheimer. Les données pertinentes ont été obtenues à partir des bases de données PubMed, EMBASE, Web of Science, China National Knowledge Infrastructure (CNKI) et Wanfang. Les articles sélectionnés ont été analysés pour identifier les principales cibles et voies de signalisation affectées par l'acupuncture.
Résultats
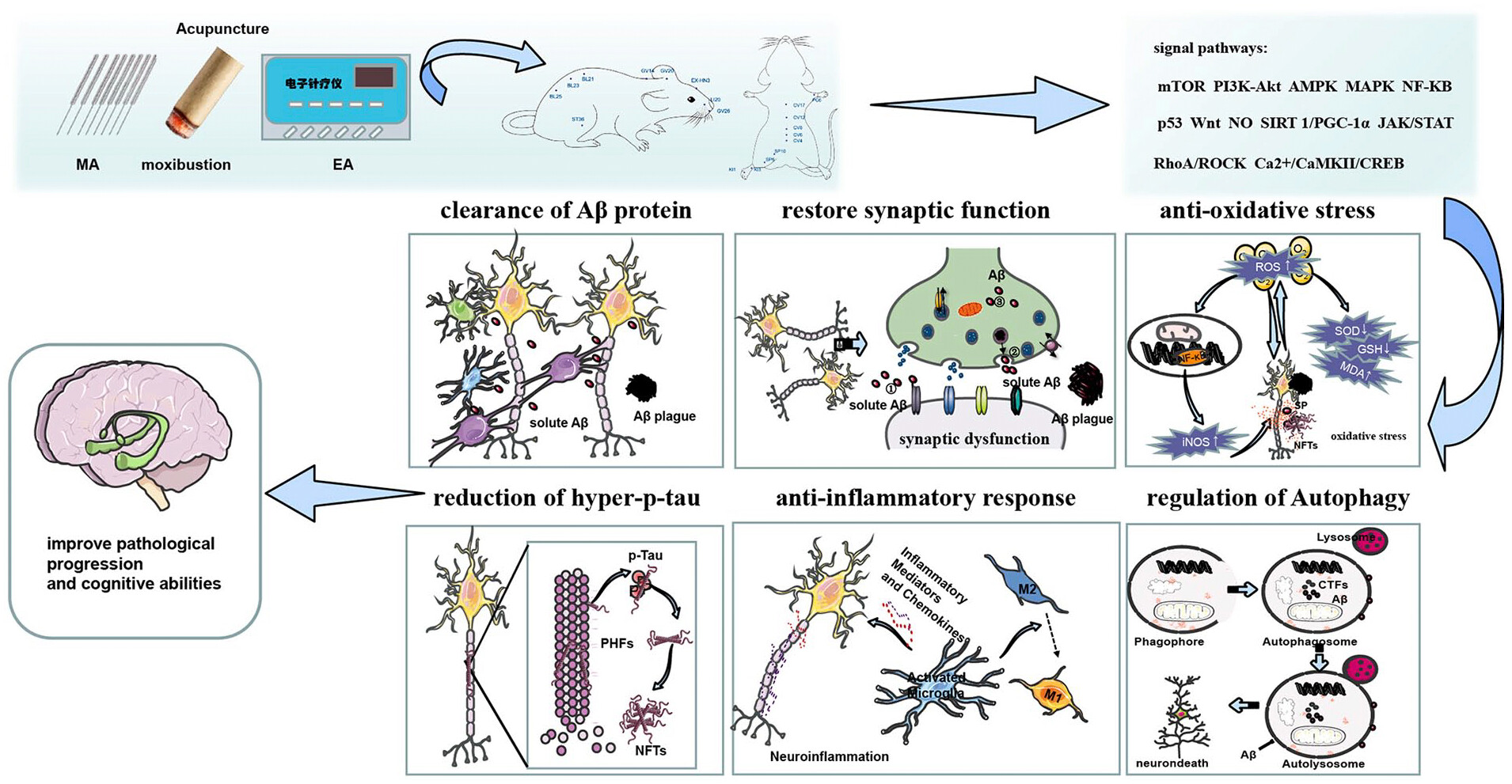
Les effets de l'acupuncture sont médiés par de multiples cibles et voies de signalisation. Les voies examinées incluent :
- La voie de la cible de la rapamycine chez les mammifères (mTOR)
- La voie de la phosphatidylinositol 3-kinase-protéine kinase B (PI3K/Akt)
- La voie de la protéine kinase activée par l'AMP (AMPK)
- La voie de la kinase activée par les mitogènes (MAPK)
- Le facteur nucléaire kappa B (NF-kB)
- La protéine p53
- La voie Wnt
- L'oxyde nitrique (NO)
- La voie Janus kinase /signal transducteur et activateur de transcription (JAK/STAT)
- La voie RhoA/ROCK (kinase associée à la protéine Rho)
- La voie de la kinase II dépendante du Ca2+/calmoduline (CaMKII)/protéine de liaison à l'élément de réponse de l'adénosine monophosphate cyclique (CREB)
L'acupuncture peut améliorer les modifications pathologiques associés à la maladie d'Alzheimer, tels que :
- La déposition anormale de la protéine amyloïde β (Aβ)
- L'hyperphosphorylation de la protéine tau
- La dysfonction synaptique
- L'apoptose neuronale
Conclusion
Bien que les mécanismes d'action précis de l'acupuncture restent à élucider, cette revue souligne son potentiel à influencer positivement les principaux processus pathologiques de la maladie d'Alzheimer à travers plusieurs voies de signalisation. Des études cliniques supplémentaires sont nécessaires pour confirmer ces résultats et déterminer l'efficacité clinique de l'acupuncture dans le traitement de cette maladie.
Commentaires
L'étude est une revue narrative sur les études expérimentales animales explorant l'efficacité et le mécanisme d'action de l'acupuncture sur des modèles animaux de maladie d'Alzheimer. 29 études publiées entre 2004 et 2022 sont incluses dans l'analyse.
Nous soulignerons :
- Les modèles animaux de maladie d'Alzheimer utilisés dans les différentes études.
- Les points d'acupuncture testés dans ces études.
- Les effets thérapeutiques potentiels relatifs à chaque voie de signalisation.
Nous rapportons enfin les détails des 29 études (modèle expérimental, points d'acupuncture et les voies identifiées).
Les modèles animaux utilisés
| Modèle animal | Description | Caractéristiques | Utilisation |
|---|---|---|---|
| APP/PS1 | Souris transgéniques exprimant des mutations humaines APP et PS1, associées à la forme familiale précoce de la maladie d'Alzheimer. | Accumulation de plaques amyloïdes, déficits cognitifs, développement de pathologies similaires à la maladie d'Alzheimer. | Étudier les effets des traitements sur l'accumulation de la protéine Aβ, les déficits cognitifs et les autres pathologies associées à la maladie d'Alzheimer. |
| 5xFAD | Souris transgéniques exprimant cinq mutations humaines associées à la maladie d'Alzheimer. | Développement rapide de plaques amyloïdes et de déficits cognitifs sévères. | Étudier les mécanismes pathologiques rapides et sévères de la maladie d'Alzheimer et tester l'efficacité des interventions thérapeutiques. |
| D-galactose (D-gal) | Administration de D-galactose pour induire un vieillissement accéléré et des pathologies semblables à celles de la maladie d'Alzheimer. | Stress oxydatif, neuroinflammation, dysfonctionnement mitochondrial, déficits cognitifs. | Modéliser le vieillissement et les processus neurodégénératifs associés à la maladie d'Alzheimer pour évaluer les effets neuroprotecteurs des traitements. |
| Aβ1-42 ou Aβ1-40 | Injection de peptides amyloïdes (Aβ1-42 ou Aβ1-40) dans le cerveau des rongeurs. | Accumulation de plaques amyloïdes, neuroinflammation, déficits synaptiques et cognitifs. | Étudier les effets des traitements sur l'accumulation de la protéine Aβ et les déficits cognitifs induits par cette accumulation. |
| SAMP8 | Souris présentant un vieillissement accéléré et des déficits cognitifs spontanés. | Augmentation de la phosphorylation de tau, stress oxydatif, neuroinflammation, déficits cognitifs progressifs. | Étudier les mécanismes de vieillissement et de neurodégénérescence, ainsi que tester les interventions thérapeutiques pour la maladie d'Alzheimer. |
| D-gal + Aβ1-42 | Combinaison d'injections de D-galactose et de peptides Aβ pour induire à la fois le vieillissement et la pathologie amyloïde. | Pathologies complexes et représentatives des aspects multiples de la maladie d'Alzheimer. | Étudier les effets synergétiques de l'accumulation de la protéine Aβ et du vieillissement accéléré sur les déficits cognitifs et la neurodégénérescence. |
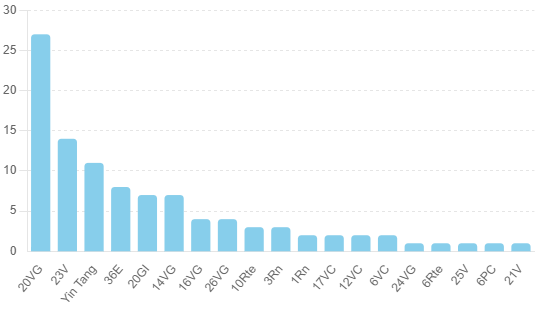
Les points d'acupuncture
Synthèse des effets thérapeutiques
| Voie de signalisation | Effets thérapeutiques principaux |
|---|---|
| mTOR | Amélioration de la plasticité synaptique, augmentation de l'autophagie, réduction de la pathologie Aβ et des enchevêtrements neurofibrillaires (NFTs) dérivés de l'agrégation anormale de la protéine tau hyperphosphorylée. |
| PI3K/Akt | Réduction de la résistance à l'insuline, inhibition de l'hyperphosphorylation de tau, amélioration de la plasticité synaptique. |
| AMPK | Engagement dans la plasticité synaptique et le métabolisme du glucose. |
| MAPK | Réduction de la déposition d'Aβ et de l'hyperphosphorylation de tau, inhibition de la réponse inflammatoire, promotion de la régénération synaptique. |
| NF-κB | Suppression de la réponse inflammatoire. |
| JAK/STAT | Ralentissement de la réponse neuroinflammatoire. |
| Wnt | Inhibition de la phosphorylation anormale de tau. |
| p53 | Effets anti-apoptotiques. |
| NO | Inhibition du stress oxydatif et des lésions inflammatoires. |
| SIRT1/PGC-1α | Augmentation de la résistance au stress oxydatif. |
| RhoA/ROCK | Amélioration de la perméabilité de la barrière hémato-encéphalique (BHE), promotion du remodelage synaptique. |
| Ca2+/CaMKII/CREB | Amélioration de la plasticité synaptique. |
Détails des études
| Référence | Traitement | Localisation des points d'acupuncture | Modèle | Mécanismes moléculaires et résultats | Voie de signalisation |
|---|---|---|---|---|---|
| Yu et al., 2020 | EA | 20VG, 23V | Modèle induit par D-gal | 📈 PSD95, synapsine-1; 📉 PHF-1, tau-5, GSK3β, GSK3β-pTyr216, mTOR, mTOR-pSer2448, LC3A/LC3B | GSK3β/mTOR |
| Zheng et al., 2020 | EA | 20VG, 23V | Modèle induit par D-gal | 📉 PHF-1, PI3K, AKT, p-AKT, mTOR | PI3K/Akt/mTOR |
| Zheng et al., 2021 | EA | Yin Tang, 20GI | Souris 5xFAD | 📈 TFEB, LAMP1, CTSD; 📉 Fl-APP, CTF, AIF1/IBA1, Aβ, LC3B-II, SQSTM1, MAPK1, p-MAPK1, AKT, p-AKT, p-MTOR, p-TFEB (S142), p-RPS6, RPS6, MTOR | Akt/MAPK1/MTORC1/TFEB |
| Jia et al., 2022 | Moxibustion | 20VG, 16VG, 14VG | AD transgénique double APP/PS1 | 📈 miR-511-3p, LC3B; 📉 Aβ1-42, lncRNAs Six3os1, PI3K, mTOR, P62, AKT3 | PI3K/Akt/mTOR |
| Zhang et al., 2019 | Moxibustion | 20VG, 16VG, 14VG | AD transgénique double APP/PS1 | 📉 Aβ1-42, PI3K, Akt, p-Akt, mTOR, p-mTOR | PI3K/Akt/mTOR |
| Zhu et al., 2019 | Moxibustion | 20VG, 16VG, 14VG | AD transgénique double APP/PS1 | 📈 LC3-II, LC3-II/I; 📉 Aβ1-42, LC3-I, p62, p-P70S6K | mTOR/P70S6K |
| Wu et al., 2022 | Moxibustion | 20VG, 16VG, 14VG | AD transgénique double APP/PS1 | 📉 Aβ1-42, mTOR, p-mTOR, p70S6K, p-p70S6K | mTOR/P70S6K |
| Jia et al., 2022 | Moxibustion | 20VG, 16VG, 14VG | AD transgénique double APP/PS1 | 📈 TFEB, cathepsine D, LAMP1, LC3-II/I; 📉 Aβ, hcRNAH19, mTOR, p62 | mTOR/TFEB |
| Yuan et al., 2021 | EA | Yin Tang, 20GI | Souris SAMP8 | 📈 p-PI3K, p-Akt | PI3K/Akt |
| Wu et al., 2020 | EA | 20VG, 23V | AD transgénique double APP/PS1 | 📈 P85α, P110α, pS21GSK3α; 📉 GSK3α, SP | PI3K/GSK3α |
| Xu et al., 2020 | EA | 20VG, Yin Tang, 26VG | AD transgénique double APP/PS1 | 📈 p-AKT(Ser473)/AKT, p-GSK3β(Ser9)/GSK3β; 📉 p-Tau(Ser199), p-Tau(Ser202) | Akt/GSK3β |
| Huang et al., 2020 | EA | 20VG, 23V, 6PC, 36E, 6Rte | Modèle induit par D-gal/ALCL3 | 📈 total CSF Tau, p-IRS1, p-IRS2, IDE, p-GSK3β; 📉 FPG, FINS, C-P, total hippocampal tau, Aβ in the CSF and hippocampus, p-PI3K-p85α, p-Akt, CSF insulin | PI3K/Akt |
| Wang et al., 2021 | EA | Yin Tang, 20GI | Modèle induit par Aβ1-42 | 📈 SYN, PSD95, GAP43, PI3K, p-AKT/AKT, p-GSK3β/GSK3β; 📉 Aβ, p-tau, IL-1β, TNF-α | PI3K/Akt/GSK3β |
| Yu et al., 2018 | EA | 20VG, 23V | Modèle induit par Aβ1-42 | 📈 p-GSK3β (Tyr216); 📉 GSK3β, p-GSK3β (Ser9), Aβ1-40 | GSK3β |
| Li et al., 2019 | AM | 17VC, 12VC, 6VC, 36E, 10Rte | Souris SAMP8 | 📉 PI3K, PDK1, nPKC, Rac1 | PI3K/PDK1/nPKC/Rac1 |
| Liu et al., 2017 | EA | 20VG | AD transgénique double APP/PS1 | 📈 GLUT1, GLUT3, p-AMPK/total-AMPK, p-AKT/total-AKT; 📉 Aβ1-42, p-mTOR/total-mTOR | AMPK/mTOR |
| Dong et al., 2015 | EA | 20VG, 23V | Souris SAMP8 | 📈 p-AMPK | AMPK |
| Dong et al., 2019 | EA | 20VG, 23V, 14VG | Souris SAMP8 | 📈 SYN, PSD95; 📉 AMPK, eEF2K, p-AMPK, p-eEF2K | AMPK/eEF2K |
| Yuan et al., 2018 | EA | Yin Tang, 20GI | AD transgénique double APP/PS1 | 📉 Aβ, p-JNK, p-ERK1/2, p-Tau(Ser 396) | JNK, ERK |
| Wang et al., 2020 | EA | Yin Tang, 20GI | Souris SAMP8 | 📈 SYP; 📉 Aβ, tau, p38MAPK, p-p38MAPK, Iba1, TMEM119 | p38MAPK |
| Min et al., 2015 | EA | 20VG, 23V | Modèle induit par Aβ1-40 | 📉 p-p38MAPK, p-tau(Thr181) | p38MAPK |
| Zhang et al., 2017 | EA | 20VG, 23V | Modèle induit par Aβ1-40 | 📈 PPAR-γ; 📉 Aβ, p-Tau(Ser404), p-p38MAPK | PPAR-γ/p38MAPK |
| Fang et al., 2013 | EA | 20VG, 3Rn, 36E | Modèle induit par Aβ1-40 | 📉 P38MAPK, IL-1β | p38MAPK |
| Tang et al., 2020 | EA | 20VG, Yin Tang, 26VG | AD transgénique double APP/PS1 | 📉 APP, JNK, P-JNK, MKK4, MKK7, p-MKK4, p-MKK7, c-Jun, caspase-3 | JNK |
| He et al., 2021 | EA | 23V, 36E | Modèle induit par D-gal | 📈 ZO-1; 📉 S-100β, LPS, TLR4, P-NF-κB p65, TNF-α, IL-6, IL-1ß, DAO | TLR4/NF-κB |
| Liao et al., 2022 | EA | 20VG, 25V, 36E | AD transgénique double APP/PS1 | 📈 Claudin-5, ZO-1; 📉 LPS, TLR4, NF-κB p65, NLRP3, caspase-1, IL-19, TNF-α, Aβ | TLR4/NF-κB/NLRP3 |
| Lu et al., 2019 | EA | 20VG, Yin Tang, 26VG | AD transgénique double APP/PS1 | 📉 Iba1, TLR4, MyD88, NF-κB, iNOS | TLR4/MyD88/NF-κB |
| Xie et al., 2021 | EA | 20VG | Modèle induit par Aβ1-42 | 📈 Arg1, IL-4, IL-10, STAT6; 📉 GFAP, Iba1, iNOS, IL-1β, TNF-α, IL-6, NF-κB p65 | NF-κB/STAT6 |
| Liu et al., 2019 | AM + Moxibustion | 20VG, 23V | Modèle induit par Aβ1-42 | 📈 SOCS3; 📉 JAK2, STAT3 | JAK/STAT |
| Hua et al., 2010 | Moxibustion + EA | 20VG, 23V | Modèle induit par Aβ25-35 | 📈 PP2A, Wnt1; 📉 GSK3β | Wnt |
| Qi et al., 2013 | EA | 20VG, 3Rn, 36E | D-gal + Aβ1-42 | 📈 SOD; 📉 MDA, p53, p21 | p53/p21 |
| Qingchun et al., 2014 | EA | 20VG, 1Rn | Modèle induit par Aβ1-40 | 📈 Beclin-1; 📉 p53 | Beclin-1/p53 |
| Liu et al., 2013 | AM | 17VC, 12VC, 6VC, 36E, 10Rte | Souris SAMP8 | 📉 p53 | p53 |
| Shuguang et al., 2004 | EA | 20VG, 1Rn, 3Rn, 10Rte | Modèle de lésion du fornix, fimbria et hippocampe | 📉 nNOS, cGMP | NO/cGMP |
| Li et al., 2020 | EA | 20VG, 24VG | AD transgénique double APP/PS1 | 📈 CD206, Arg1; 📉 iNOS, IL-1β, Aβ | NO/cGMP |
| Huang et al., 2018 | EA | 14VG, 23V | Souris SAMP8 | 📈 ATP, SIRT1, PGC-1α | SIRT1/PGC-1α |
| Dong et al., 2015 | EA | 14VG, 36E | Modèle induit par D-gal/Aβ1-40 | 📈 SIRT1, PGC-1α | SIRT1/PGC-1α |
| Wang et al., 2021 | AM | 17VC, 12VC, 6VC, 36E, 10Rte | Souris SAMP8 | 📈 F-actine, p-cofiline; 📉 Aβ42, p-tau, RhoA, ROCK | RhoA/ROCK |
| Du et al., 2020 | Moxibustion | 23V, 21V | Modèle induit par D-gal | 📈 p-CREB, p-CaMKII, CaMKII, CREB | Ca2+/CaM-CaMKII-CREB |
| Niu et al., 2015 | EA | Yin Tang, 20GI | Modèle induit par Aβ1-40 | 📈 CaMKII; 📉 Ca2+ | Ca2+/CaM-CaMKII |
Abbreviations: EA: electroacupuncture, AM: acupuncture manuelle; 📈: en hausse; 📉: en baisse; SAMP8: senescence-accelerated prone 8; APP/PS1: amyloid precursor protein/presenilin 1; 5xFAD: 5x-familia-AD; D-gal: D-galactose; Aβ: β-amyloid; PSD95: postsynaptic density protein-95; PHF-1: paired helical filament-1; GSK: glycogen synthase kinase; mTOR: mammalian target of rapamycin; LC: light chain; PI3 K: phosphatidylinositol 3-kinase; AKT: protein kinase B; p, phosphorylated; TFEB: transcription factor EB; LAMP1: lysosomal-associated membrane protein 1; CTSD: cathepsin D; CTF: C-terminal fragment; AIF1/IBA1: allograft inflammatory factor 1; SQSTM1: sequestosome-1; MAPK: mitogen-activated protein kinase; RPS6: ribosomal protein S6; F1-APP: full-length (Fl)-APP; p70S6K: p70 ribosomal protein S6 kinase; SP: senile plaques; CSF: cerebrospinal fluid; IDE: insulin degradation enzyme; IRS1: insulin receptor substrate 1; FPG: fasting plasma glucose; FINS: fasting plasma insulin; C-P: C-peptide; SYN: synapsin; GAP43: growth-associated protein-43; IL: interleukin; TNF: tumor necrosis factor; PDK1: phosphoinositol-dependent kinase 1; nPKC: novel protein kinase C; Rac1: Ras-related C3 botulinum toxin substrate; GLUT: glucose transporter; AMPK: adenosine monophosphate-activated protein kinase; eEF2K: elongation factor 2 kinase; ERK: extracellular signal-regulated kinase; JNK: p-c-Jun N-terminal kinase; MKK: MAPK kinase; ZO: zonula occludens; PPAR-γ: peroxisome proliferator-activated receptor γ; LPS: lipopolysaccharide; TLR: toll-like receptor; NF-kB: nuclear factor-kB; DAO: D-amino acid oxidase; NLRP3: nucleotide-binding oligomerization domain (Nod)-link receptor (NLR) family pyrin domain containing 3; MyD88: myeloid differentiation primary response 88; Arg1: Arginase 1; GFAP: glial fibrillary acidic protein; iNOS: inducible nitric oxide synthase; SOCS3: suppressor of cytokine signaling 3; JAK: Janus kinase; STAT: signal transducer and activator of transcription; PP2A: protein phosphatase 2A; Wnt: Wingless-related integration site; MDA: malondialdehyde; SOD: superoxide dismutase; cGMP: cyclic guanosine monophosphate; CD206: M2 phenotypes express mannose receptor; PGC-1α: PPAR-γ coactivator-1α; SIRT1: silent information regulator 1; ROCK: Rho-associated protein kinase; CaMKII/CREB: calmodulin-dependent protein kinase II / cyclic adenosine monophosphate-response element-binding protein.
Dr Johan Nguyen
Mots-clés : Acupuncture expérimentale- mécanismes d'action - Neurologie
